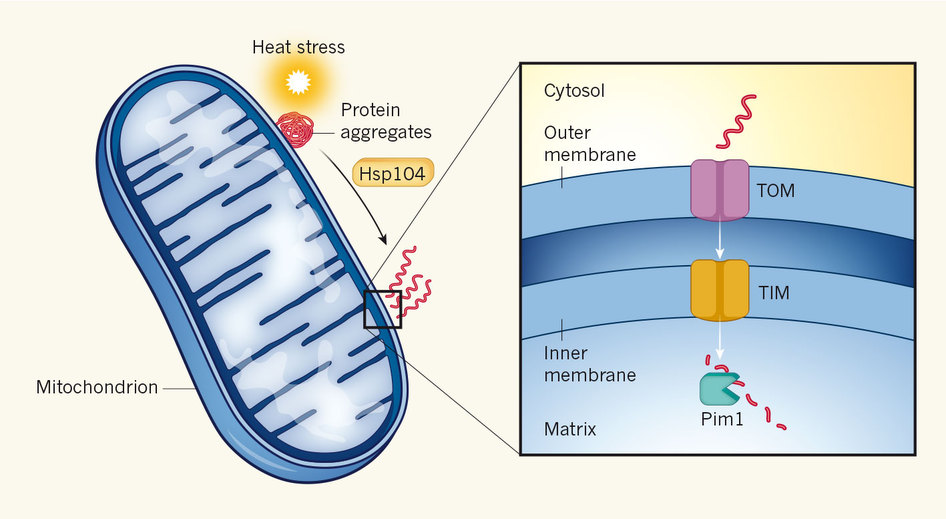
Lors d’un choc de température, on sait que la quantité de protéines mal reployées va augmenter : en effet, si la température augmente, l’agitation moléculaire augmente donc cela peut casser des liaisons faibles entre les radicaux des acides aminés, donc en mettre en place d’autres, donc indure un mauvais reploiement. On sait aussi que certaines protéines, les HSP, sont normalement chargées d’empêcher cela. Cependant, il y a tellement de protéines dans la cellule qu’une partie va forcément échapper à la surveillance. Une partie de ces protéines mal reployées vont avoir tendance à s’agréger et donc à former des complexes qui pourraient etre dangereux. Ces complexes doivent donc etre détruits. Une structure impliquée dans la destruction des protéines est le protéasome mais ce n’est pas de lui dont il est question ici. Dans un article publié dans Nature, Ruan rapporte que dans des conditions de stress thermique, les agrégats de protéines formées ont tendance à s’accumuler au niveau de la surface des mitochondries. Une protéine chaperon, HSP104, désagrège l’agrégat, et une partie est ensuite transportée à l’intérieur de la mitochondrie via le complexe TOM-TIM. Une fois dans la mitochondrie, la protéase Pim1 dégrade les protéines qui sont entrées si elle ne sont pas destinés au fonctionnement de la mitochondrie.